Therapie 2.0.
Text: Yvonne Vahlensieck
Einige Tumore lassen sich mit einer Immuntherapie sehr gut bekämpfen, andere dagegen weniger. Basler Forschende wollen alle Krebszellen angreifbar machen.
Vor gut zehn Jahren weckte eine neue Generation von Krebstherapien grosse Hoffnungen. Die Idee: Das Immunsystem – von Natur aus darauf getrimmt, unseren Körper gegen gefährliche Eindringlinge zu verteidigen – soll die Krebszellen vernichten.
Der anfängliche Hype war nicht unbegründet. «Die Immuntherapie ist inzwischen zum Standard bei Krebserkrankungen geworden, schätzungsweise bekommen mehr als 40 Prozent unserer Patientinnen und Patienten eine solche Behandlung», sagt Heinz Läubli, Leiter einer Forschungsgruppe auf dem Gebiet der zellulären Krebsimmuntherapie an der Universität Basel sowie leitender Arzt Onkologie am Universitätsspital Basel.
Der Begriff Krebsimmuntherapie umfasst verschiedene Methoden, um das Immunsystem für den Kampf gegen bösartige Zellen zu aktivieren. Häufig zum Einsatz kommen sogenannte Checkpoint-Inhibitoren. Sie basieren auf dem Wissen, dass Tumorzellen natürliche Blockaden des Immunsystems, sogenannte Checkpoints, für ihre Zwecke ausnutzen, um sich vor dem Angriff der Immunzellen zu schützen.
Krebszellen aktivieren diese Blockaden, indem sie bestimmte Strukturen auf ihrer Zelloberfläche präsentieren. Checkpoint-Inhibitoren heben diesen Mechanismus auf – etwa indem sie die entsprechenden Strukturen auf den Krebszellen medikamentös überdecken. In der Folge werden die Blockaden des Immunsystems nicht aktiviert und es kann die Tumorzellen mit voller Kraft angreifen.
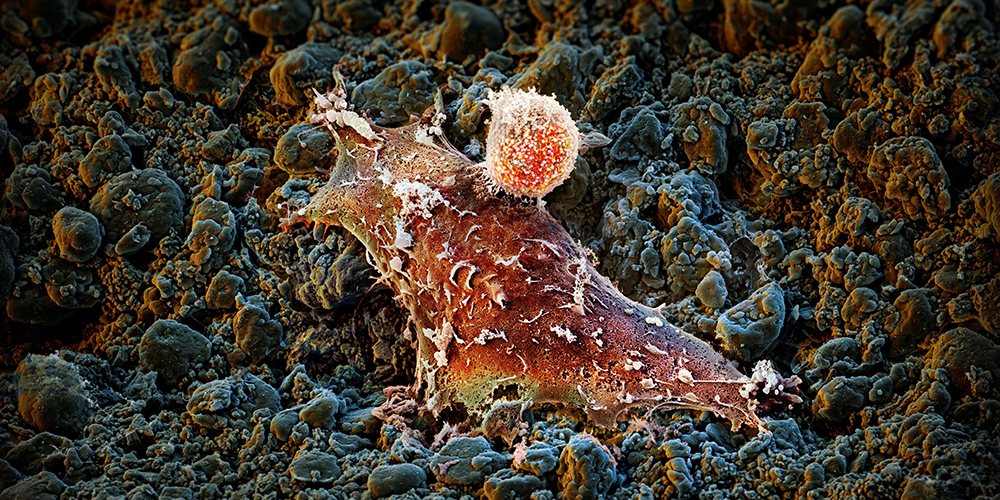
Ein weiterer Ansatz ist die zelluläre Immuntherapie: Hierfür werden beispielsweise bestimmte weisse Blutkörperchen, T-Zellen genannt, aus dem Blut von Krebserkrankten herausgefiltert und genetisch so modifiziert, dass sie nach Rückkehr in den Körper die Tumorzellen besser erkennen. Eine dieser Methoden, die CAR-T-Zell-Therapie, funktioniert besonders gut gegen Blutkrebs.
Tumore tricksen Immunsystem aus
«Durch neue Immuntherapien hat es in den letzten Jahren deutliche Fortschritte gegeben, die vielen Menschen geholfen haben», so Läubli. Gerade bei Krebsarten wie Lungenkrebs und Melanomen (Hautkrebs) im fortgeschrittenen Stadium, bei denen die Überlebenschancen früher gering waren. «Die Daten zeigen, dass beim Schwarzen Hautkrebs sechs Jahre nach der Immuntherapie noch die Hälfte der Behandelten am Leben ist.» Die Pharmafirmen bringen deswegen ständig neue Produkte auf den Markt. Allein in den letzten drei Jahren wurden von den amerikanischen Behörden über fünfzig neue Krebsimmuntherapien zugelassen, viele davon in Kombination mit bereits etablierten Chemotherapien.
«Trotzdem ist eine gewisse Ernüchterung eingetreten», sagt Alfred Zippelius, ebenfalls Forschungsgruppenleiter am Departement Biomedizin und Co-Chefarzt Onkologie. Denn: Gut zwei Dritteln der Behandelten bringen die neuen Therapien nur wenig.
An einem Ende des Spektrums sind «heisse» Tumore, bei denen eine Immuntherapie sehr gut wirkt, am anderen Ende leider auch «kalte», denen das Immunsystem nichts anhaben kann. Woran das liegt, haben Krebsforschende wie Zippelius und Läubli in den letzten Jahren herausgefunden. Hierzu führen sie Experimente mit menschlichem Tumorgewebe sowie mit Mäusen durch.
Was man jetzt weiss: Die Wirksamkeit einer Immuntherapie hängt nicht von der jeweiligen Krebsart ab, sondern von den individuellen Eigenschaften jedes Tumors. Besonders gut geschützt sind etwa Krebszellen, die rein äusserlich keine grossen Unterschiede zu normalen Körperzellen aufweisen. In anderen Fällen machen die Tumore die Schotten dicht; sie verhindern, dass die Zellen des Immunsystems überhaupt in ihr inneres Gewebe vordringen können.
Mittlerweile ist es aber möglich, die Typen von weissen Blutkörperchen, die den Tumor erfolgreich infiltrieren, aus Krebsgewebe zu isolieren, im Labor zu vermehren und wieder dem Blut der Patienten und Patientinnen zuzuführen. Dies unterstützt den Effekt der Therapie. Die Methode wird daher derzeit am Universitätsspital Basel in klinischen Studien erprobt.
Eine Frage der Nachbarschaft
Ob eine Immuntherapie wirkt oder nicht, hängt also auch von der Mikroumgebung der Tumore ab, wie die Forschungsgruppe von Zippelius in den letzten Jahren belegt hat. Gemeint ist die Mischung aus verschiedenen Zelltypen und Signalstoffen in unmittelbarer Nähe der Krebszellen. «Wir wollen verstehen, welche Faktoren zusammenkommen müssen, um eine erfolgreiche Immuntherapie gegen den Tumor zu begünstigen», so Zippelius.
In einer kürzlich erschienenen Studie konnte sein Team beispielsweise zeigen, dass ein bestimmter Signalstoff hilft, die richtigen Immunzellen in den Tumor zu locken. Allerdings ist dies nur einer von Hunderten Faktoren, die eine Rolle spielen. Ohne die mechanistischen Zusammenhänge besser zu verstehen, ist es laut Zippelius schwierig, die Mikroumgebung des Tumors gezielt zu manipulieren: «Wenn wir uns dieser Komplexität nicht stellen, werden wir keinen Erfolg haben.»
Ein Schutzmantel aus Zucker
Ebenfalls neue Wege geht Läubli mit seinem Team. Bisher lag der Fokus der Immuntherapien vor allem auf Eiweissen, die Tumorzellen auf ihrer Oberfläche tragen. Aber Krebszellen sind auch gespickt mit einem Übermass an Zuckerketten – und wie sich herausgestellt hat, bilden diese eine Art Schutzschirm gegen Angriffe durch das Immunsystems. In ihren Versuchen haben Forschende um Läubli diese Zuckerketten gezielt zerschnitten. Das Resultat: Die Immunzellen konnten besser angreifen.
Neben den «kalten» Tumoren gibt es noch ein weiteres grosses Problem bei der Krebsimmuntherapie: Nach einigen Wochen oder Monaten sind die T-Zellen erschöpft und schaffen es nicht mehr, die Krebszellen zu vernichten. Die Basler Forschungsgruppen haben nun eine Methode entwickelt, dieses Phänomen zu untersuchen. Dabei identifizierten sie ein Gen in den T-Zellen, das ihren Erschöpfungszustand vorantreibt. Ohne dieses Gen bleiben die T-Zellen dauerhaft fit. Ein möglicher Therapieansatz wäre also, bei zellulären Immuntherapien dieses Gen in den entnommenen T-Zellen auszuschalten, bevor sie wieder in den Blutkreislauf der Patientin oder des Patienten eingebracht werden.
Die Zukunft der Krebsbehandlung sieht Zippelius in der richtigen Kombination von verschiedenen Therapien − idealerweise genau abgestimmt auf die Eigenschaften des jeweiligen Tumors. Doch dieses Ziel ist noch nicht in greifbarer Nähe. «Nach all den Jahren haben wir das Potenzial der Krebsimmuntherapien noch bei Weitem nicht ausgeschöpft», so Zippelius. «Wir werden nach wie vor sehr viel an Forschungsarbeit investieren müssen, um mehr aus diesen Therapien herauszuholen.»
Weitere Artikel dieser Ausgabe von UNI NOVA (Mai 2023).