Optimiertes Enzym baut präzise komplexe Moleküle
Forschende der Universität Basel haben ein natürliches Enzym so verändert, dass es eine höchst anspruchsvolle chemische Reaktion katalysiert. Komplexe Moleküle für Arzneistoffe und Feinchemikalien könnten dadurch umweltfreundlicher und effizienter hergestellt werden.
30. Juli 2025 | Stéphanie Hegelbach
Katalysatoren gehören zu den wichtigsten Werkzeugen auf dem Weg zu einer nachhaltigeren grünen Chemie. Sie beschleunigen chemische Reaktionen, machen sie effizienter und besser steuerbar. Dadurch können bei der Herstellung von verschiedensten Produkten Energie, Abfall und Kosten eingespart werden. Die Suche nach neuen Katalysatoren beschäftigt die Chemie durchgehend seit dem 20. Jahrhundert.
Vielversprechende Methode mit einem Haken
In jüngster Zeit gilt der sogenannte Metallhydrid-Wasserstoffatom-Transfer (MHAT) als vielversprechende katalytische Methode. Mit der MHAT-Reaktion lassen sich effizient komplexe Moleküle mit bestimmten Funktionen aufbauen. Eine Verbindung aus einem Metall- und einem Wasserstoffatom – ein sogenanntes Metallhydrid – überträgt dabei ein Wasserstoffatom auf einen Kohlenwasserstoff mit mindestens einer Doppelbindung. Dabei entsteht eine besonders reaktionsfreudige Stelle, die im Folgenden eine Verbindung mit einer Gruppe von Atomen eingeht. Diese funktionelle Gruppe bestimmt die chemischen Eigenschaften des Moleküls.
Die MHAT-Reaktion kann ein flaches, zweidimensionales Substrat in ein komplexes Molekül mit einer dreidimensionalen Architektur umwandeln. Allerdings ist es schwierig, die präzise dreidimensionale Anordnung der Atome im Molekül zu steuern. Denn obwohl zwei Moleküle aus den gleichen Atomen bestehen, können sie sich wie Bild und Spiegelbild verhalten und nicht zur Deckung gebracht werden. Man kann sich die beiden Molekülvarianten – sogenannte Enantiomere – wie linke und rechte Hände vorstellen.
Für die pharmazeutische Industrie oder die Herstellung von Feinchemikalien ist die Erzeugung einer bestimmten Konfiguration jedoch zentral. Denn die beiden spiegelbildlichen Moleküle können unterschiedliche biologische Eigenschaften haben. So kann beispielsweise das Spiegelbild eines Arzneistoffs eine komplett andere oder gar toxische Wirkung haben.
Enzym produziert gewünschte Konfiguration
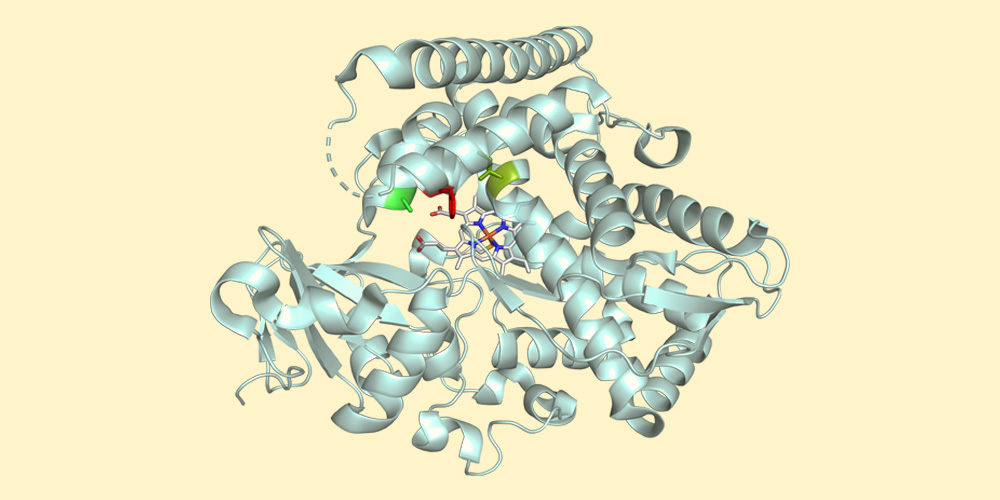
Forschenden der Universität Basel ist es nun gelungen, die MHAT-Chemie mit enzymatischer Katalyse zu kombinieren, um gezielt ein gewünschtes Enantiomer zu produzieren. Für die in der Fachzeitschrift «Nature» publizierte Studie macht sich das Team um Prof. Dr. Thomas R. Ward das Schlüssel-Schloss-Prinzip von natürlichen Enzymen zunutze.
Jedes Enzym besitzt ein aktives Zentrum – eine Art Tasche, in die nur eines oder wenige bestimmte Moleküle hineinpassen wie der Schlüssel ins Schloss. Die Forschungsgruppe hat ein Hämoprotein – ein in der Natur weit verbreitetes Enzym – so umfunktioniert, dass die MHAT-Reaktion im aktiven Zentrum des Enzyms stattfindet. Durch die spezifische Umgebung dieser Enzym-Tasche entsteht in 98 von 100 Fällen das gewünschte Enantiomer, da dessen Spiegelbild nicht in das aktive Zentrum passen würde.
Diese Reaktion ist mit üblichen chemischen Werkzeugen äusserst schwierig zu realisieren. Dank dem Enzym läuft sie nicht nur präzise, sondern auch effizient ab. Enzyme haben ihre katalytischen Eigenschaften über Millionen von Jahren weiterentwickelt, um Leben mit minimalem Energieaufwand aufrechtzuerhalten. Sie sind für die Chemie darüber hinaus aufgrund ihrer Umweltfreundlichkeit interessant. «Bisher war jedoch noch kein Enzym bekannt, das die MHAT-Reaktion durchführen kann», erklärt Erstautor Dr. Xiang Zhang.
Spezifität – Fluch und Segen zugleich
Dieser Durchbruch im Bereich der enzymatischen Katalyse ebnet den Weg für eine umweltfreundlichere und effizientere Produktion einer Vielzahl komplexer chemischer Strukturen – beispielsweise für die Pharmaindustrie oder für die Herstellung von Naturprodukten. Die richtungsweisende Forschung ist Teil des Nationalen Forschungsschwerpunkts «Molecular Systems Engineering», den Thomas Ward leitet.
Die Spezifität des Enzyms ist jedoch Fluch und Segen zugleich: Denn möchten die Forschenden das Enzym auf einen anderen Ausgangsstoff anwenden, müssen sie zuerst wieder die Struktur des Enzyms anpassen. Die Forschungsgruppe widmet sich nun dieser Herausforderung und sucht zudem nach einem nachhaltigeren Weg, um das Metallhydrid herzustellen, das für die Reaktion benötigt wird.
Originalpublikation
Xiang Zhang, Dongping Chen, María Álvarez, Thomas R. Ward
Repurposing haemoproteins for asymmetric metal-catalysed H atom transfer
Nature (2025), doi: 10.1038/s41586-025-09308-0