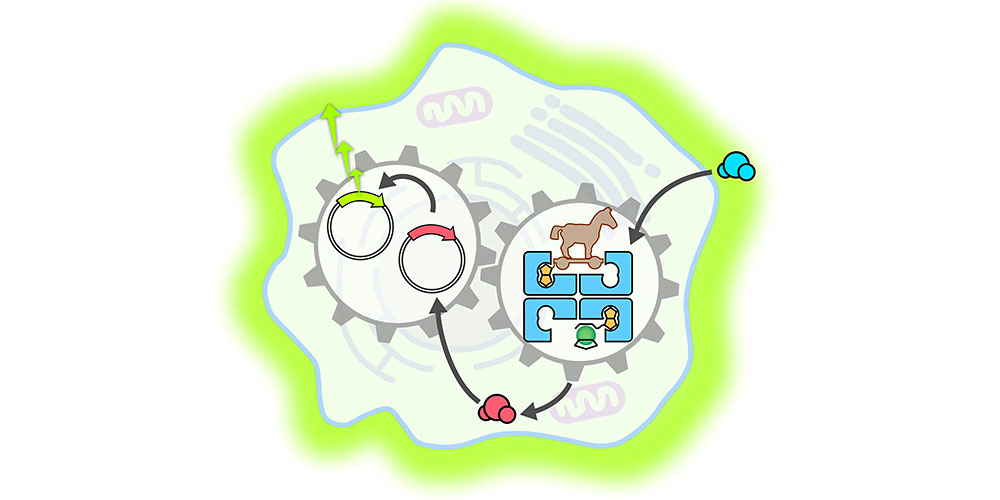
Designerzellen: Künstliches Enzym kann Genschalter betätigen
In künstlichen molekularen Systemen lassen sich komplexe Reaktionskaskaden auslösen: Schweizer Wissenschaftler haben ein Enzym konstruiert, das in eine Säugerzelle eindringen kann und dort die Freisetzung eines Hormons beschleunigt. Dieses wiederum aktiviert einen Genschalter, der die Herstellung eines Leuchtproteins auslöst. Das berichten Forschende des NFS Molecular Systems Engineering, der von der Universität Basel und der ETH Zürich geleitet wird.
22. Mai 2018
Die Natur ist auf Enzyme angewiesen, um energetisch aufwändige biochemische Reaktionen zu beschleunigen, die für den Erhalt des Lebens notwendig sind. Natürliche Enzyme eignen sich jedoch nicht gleichermassen für sämtliche Reaktionstypen. Im Gegensatz dazu sind künstlich hergestellte Katalysatoren vielseitiger, denn sie können viel mehr chemische Syntheseprozesse optimieren.
Entsprechend vielversprechend ist es, künstliche Katalysatoren in lebende Zellen und Organe einzubringen, um so Zellfunktionen auf genetischer Ebene zu verändern oder ein Medikament aus einer harmlosen Vorläufersubstanz gleich in der Zelle herstellen zu lassen. Doch funktionieren solche Katalysatoren oft nur unter streng kontrollierten Bedingungen, die im Umfeld lebender Zellen kaum möglich sind.
Kaskade künstlicher Komponenten
Um diese Einschränkung zu überwinden, haben Forschende der Universitäten Basel (Prof. Thomas Ward) und Genf (Prof. Stefan Matile) sowie der ETH Zürich (Prof. Martin Fussenegger) einen kleinmolekularen Katalysator entwickelt, der einen Genschalter steuern kann. Wird dieser Schalter betätigt, löst das die gewünschte Zellfunktion aus.
Für die vorliegende Studie stellten die Forscher ein sogenanntes Metalloenzym her – ein biokompatibles Protein, in das ein katalytisch aktives Metallfragment (in diesem Fall aus Ruthenium) eingebaut ist. Dabei ist es erstmals gelungen, ein künstliches Metalloenzym zu entwickeln, das in der Lage ist, in eine Säugerzelle einzudringen.
In der Zelle angekommen, entfaltete das Metalloenzym – gleich einem Trojanischen Pferd – seine katalytische Funktion und beschleunigte die Produktion eines bestimmten Schilddrüsenhormons. Dieses Hormon betätigte anschliessend einen synthetischen Genschalter, der wiederum zur Herstellung eines leuchtenden Proteins namens Luciferase geführt hat.
Neuartige Chemie in lebenden Organismen
Die in «Nature Communications» erschienene Studie belegt die Machbarkeit eines innovativen Ansatzes, der auf die Entwicklung von Zellfunktionen abzielt und traditionelle biochemische Prozesse zu ergänzen vermag. Die Arbeit zeigt beispielhaft, welche Möglichkeiten die Verbindung von synthetischer Biologie und metallorganischer Chemie für die Steuerung von Zellfunktionen in lebenden Organismen eröffnet.
Originalbeitrag
Yasunori Okamoto, Ryosuke Kojima, Fabian Schwizer, Eline Bartolami, Tillmann Heinisch, Stefan Matile, Martin Fussenegger & Thomas R. Ward
A cell-penetrating artificial metalloenzyme regulates a gene switch in a designer mammalian cell
Nature Communications (2018), doi: 10.1038/s41467-018-04440-0
Weitere Auskünfte
Prof. Dr. Thomas R. Ward, Universität Basel, Departement Chemie, Tel. +41 61 267 10 04, E-Mail: thomas.ward@unibas.ch
NCCR Molecular Systems Engineering
Der NCCR Molecular Systems Engineering ist ein nationaler Forschungsschwerpunkt (NFS), der vom Schweizerischen Nationalfonds finanziert und von der Universität Basel und der ETH Zürich geleitet wird. Der NFS vereint Kompetenzen aus Chemie, Biologie, Physik, Bioinformatik und den Ingenieurwissenschaften. Das übergreifende Ziel ist die Entwicklung von Werkzeugen und Geräten zur Überwachung und Manipulation von (bio-)chemischen Systemen. Diese können in der Synthese von Produkten mit hoher Wertschöpfung, als innovative Diagnosewerkzeuge und zur Wiederherstellung einer gewünschten Zell- oder Organfunktion eingesetzt werden.