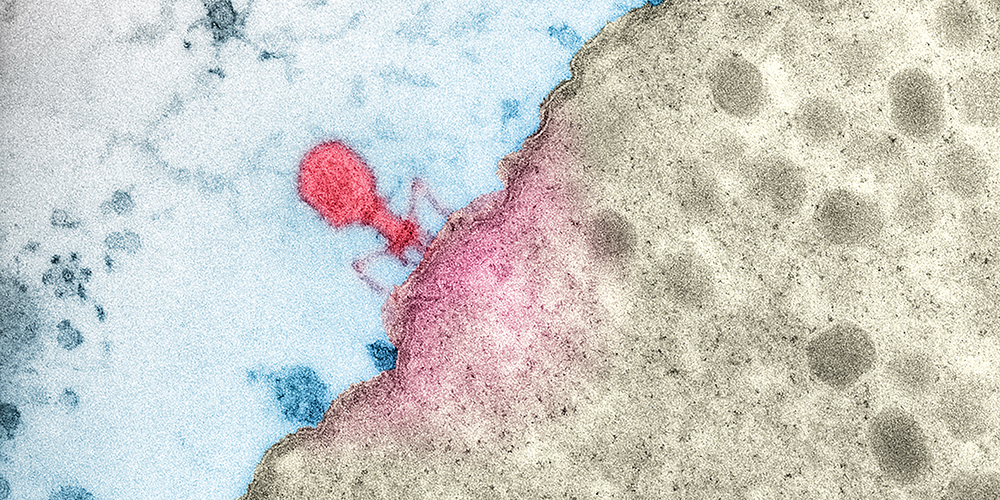
Bakterien mit Viren bekämpfen.
Text: Yvonne Vahlensieck
Phagen sind auf Bakterien spezialisierte Viren, die ein grosses
Potenzial für die Therapie von Infektionen haben. Basler Wissenschaftler
suchen in freier Natur nach neuen Phagenarten, mit deren
Hilfe sie die Schwachstellen von Bakterien identifizieren wollen.
Wenn der Mikrobiologe Dr. Alexander Harms vom Biozentrum der Universität Basel nach frischem Material für seine Forschung sucht, geht er an den Rhein, zu einer Kläranlage oder in einen nahegelegenen Park. In den Proben, die er dort nimmt, wimmelt es nur so von seinen Versuchsobjekten – den sogenannten Bakteriophagen. Diese Phagen sind Viren, die in das Innere von Bakterienzellen eindringen und sich dort vermehren. Da die Bakterien bei diesem Prozess abgetötet werden, gelten die Phagen als die neue Wunderwaffe im Kampf gegen Infektionen – zumal derzeit immer mehr Krankheitserreger Resistenzen gegen Antibiotika entwickeln.
Rückbesinnung auf alte Ideen
Dieser Ansatz ist allerdings nicht ganz neu: Schon vor rund 100 Jahren setzten experimentierfreudige Mediziner solche Phagen erfolgreich zur Bekämpfung von bakteriellen Infektionen ein. Doch nach der Entdeckung der Antibiotika geriet die Methode bei uns bald darauf fast in Vergessenheit. Phagen dienten anschliessend weiterhin als wichtiges Modellsystem in der molekularbiologischen Forschung, aber in den 1980er-Jahren rückten sie endgültig in den Hintergrund. «Während die Forschung in anderen Bereichen kontinuierlich weitergelaufen ist, gab es bei der Phagenforschung einen Generationenbruch», erklärt Harms. Er findet dies sehr bedauerlich, zumal das Biozentrum einst weltweit führend auf diesem Gebiet war. So erhielt der Basler Mikrobiologie-Professor Werner Arber 1978 den Nobelpreis für Forschungsarbeiten, bei denen Phagen eine zentrale Rolle spielten.
Angesichts der Antibiotikakrise hat das Interesse an der Phagenforschung in den letzten Jahren wieder stark zugenommen. «Durch eine Fülle von neuen Techniken, beispielsweise durch das schnelle Sequenzieren des Erbguts, wurde den Forschenden erst richtig klar, wie viele unbekannte Arten von Phagen es noch zu entdecken gibt», sagt Harms. In jedem Wassertropfen, in jedem Krümel Erde stecken Abertausende von Phagen – darunter mit hoher Wahrscheinlichkeit auch solche, die das Potenzial haben, gefährlichen Bakterien den Garaus zu machen. Und das mithilfe von Mechanismen, die der Wissenschaft bislang noch unbekannt sind.
Schlafende Bakterien im Visier
Genau hier setzt das Forschungsprojekt von Harms an: Aus seinen Proben isoliert er Phagen, die die Fähigkeit haben, Krankheitserreger wie Salmonellen, Kolibakterien oder Staphylokokken abzutöten. Die vielversprechendsten Exemplare unterzieht der Wissenschaftler dann einer genaueren Analyse. Zum Einsatz kommen dabei neueste molekularbiologische Techniken, aber auch viele der klassischen Methoden, die vor Jahrzehnten am Biozentrum mitentwickelt wurden. Das Ziel: herausfinden, mit welchen Tricks die Phagen die Bakterien ausschalten und welche Gene dabei eine Rolle spielen.
Besonderes Augenmerk richtet Harms dabei auf Bakterien, die sich einer Antibiotikabehandlung dadurch entziehen, dass sie zeitweilig in eine Art Tiefschlaf verfallen. Diese sogenannten Persisterzellen sind vermutlich für chronische Infektionen wie Blasen- und Lungenentzündungen bei Patienten mit Zystischer Fibrose verantwortlich. Trotz mehrfacher Antibiotikabehandlung verschwinden diese chronischen Infektionen nie vollständig, sondern flammen immer wieder neu auf und verlaufen im schlimmsten Fall tödlich. Harms sucht deshalb gezielt nach Phagen, die Bakterien in einem solchen Schlafzustand angreifen können: «Wir wollen dann jene Gene in den Phagen identifizieren, die dabei helfen, die Persisterzellen zu vernichten.
Ziel: Phagen konstruieren
Dieser systematische Ansatz unterscheidet sich stark von der klassischen Phagentherapie, über die in letzter Zeit häufig in den Medien berichtet wird: Dort suchen Ärzte – etwa in Wasserproben aus Kläranlagen – nach einem Phagen, der zufällig genau jenes Bakterium angreift, mit dem ein bestimmter Patient infiziert ist. Dieser Phage wird dann vermehrt und dem Patienten oft unter Zeitdruck ohne genaue Analyse seiner Wirkungsweise verabreicht. Harms betrachtet dieses Vorgehen mit Sorge: «Das Problem ist, dass alles sehr empirisch ist. Man weiss nicht genau, was zwischen Phagen und Bakterien im Körper der Patienten passiert und warum es in einem Fall funktioniert, im anderen nicht.»
Der Plan des Forschers ist es deshalb, nach und nach ein ganzes Arsenal an Phagengenen zu sammeln und daraus basierend auf einigen bekannten Grundtypen massgeschneiderte Phagen zu konstruieren. Diese könnten beispielsweise speziell auf die Bekämpfung von chronischen Krankheiten zugeschnitten sein. Davon würden dann nicht nur einzelne Erkrankte, sondern grössere Gruppen von Patienten profitieren. Harms hofft auch, dass die durch seine Analysen gewonnenen Erkenntnisse dazu beitragen, gezielt weitere antibakterielle Medikamente zu entwickeln.
Keine Probleme durch Resistenz
Der Einsatz von Phagen hat noch einen weiteren Vorteil gegenüber der Antibiotikatherapie: Das Risiko, dass Bakterien eine dauerhafte Resistenz gegen Phagen entwickeln, ist nach Einschätzung von Experten sehr gering. Selbst wenn sich bei den Bakterien Abwehrmechanismen gegen Phagen bilden, passen sich diese sehr schnell an. Bei diesem Wettrüsten haben die Phagen schon seit Millionen von Jahren die Nase vorn. «Bakterien evolvieren sehr schnell. Aber es gibt etwas, das noch schneller evolviert, und das sind Phagen », so Harms. Er möchte seine nach Mass gebauten Phagen zusätzlich so ausstatten, dass sie die Bakterien gleichzeitig an mehreren verletzlichen Stellen angreifen. Dadurch verringert sich die Gefahr, dass Bakterien den Phagen durch eine einfache Anpassung entwischen können. Auch das Auftreten von gefährlichen Nebenwirkungen ist nicht wahrscheinlich, denn nach bisherigen Erfahrungen sind Phagen für den Menschen ungefährlich.
Nicht nur Harms, sondern auch viele Forschende auf der ganzen Welt sind überzeugt, dass es in der Welt der Phagen noch viel Neues zu entdecken gibt. Dies durften etwa auch die Gymnasiastinnen und Gymnasiasten erfahren, die in diesem Sommer an der «Basel Summer Science Academy» teilgenommen haben. Sie sammelten Proben aus dem Rhein und isolierten daraus Phagen, die Harms nun genauer charakterisieren will. Vielleicht enthält eines dieser Exemplare ein noch unentdecktes Gen, das in Zukunft dabei hilft, Menschen mit schweren Infektionskrankheiten wieder vollständig gesund zu machen.
Weitere Artikel in der aktuellen Ausgabe von UNI NOVA.