Augenlicht dank Gentherapie.
Text: Yvonne Vahlensieck
Die Stargardt-Krankheit ist eine erbliche Erkrankung, die bereits bei Jugendlichen zum Verlust des scharfen Sehens führt. In Basel entwickeln Wissenschaftler und Kliniker gemeinsam eine Gentherapie, um der Krankheit entgegenzuwirken. Schon in wenigen Jahren soll die Methode an Patientinnen und Patienten erprobt werden.
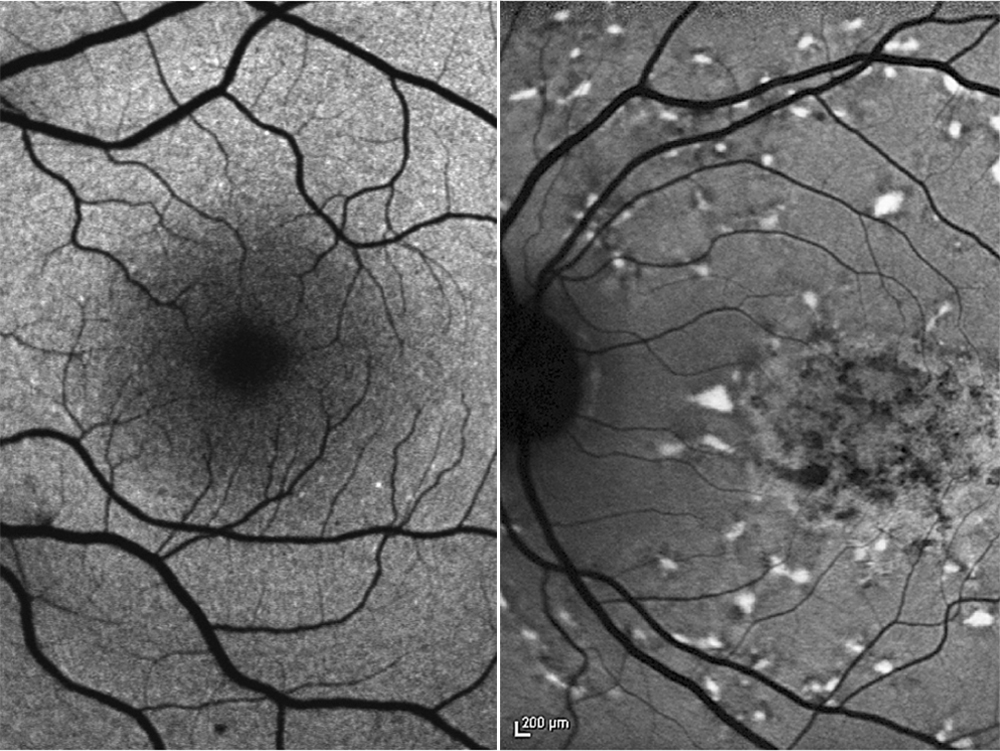
Der gelbe Fleck auf der Netzhaut ist gerade einmal sechs Millimeter gross – und trotzdem unglaublich wichtig: Denn dort liegt das Zentrum für das scharfe Sehen, ohne das wir unsere Umgebung nur schemenhaft wahrnehmen können. «Gerade in der modernen Gesellschaft sind wir ständig auf scharfes Sehen angewiesen», erklärt Prof. Dr. Hendrik Scholl, Co-Direktor des Instituts für Molekulare und Klinische Ophthalmologie in Basel (IOB): «Wir schauen auf das Handy, arbeiten am Computer und für soziale Interaktionen müssen wir das Gesicht unseres Gegenübers erkennen.» Deshalb führen Netzhauterkrankungen, die den gelben Fleck zerstören, zu einer signifikanten Verschlechterung der Lebensqualität.
Gendefekt mit schlimmen Folgen
Eine dieser Erkrankungen ist die erbliche Stargardt- Krankheit, die meist im Jugendalter beginnt und rasch zu einem kompletten Verlust der Sehschärfe führt. Die Betroffenen bleiben zwar einigermassen mobil, doch können sie weder lesen noch Details in ihrer Umwelt erkennen. Noch gilt die Krankheit als unheilbar – doch das könnte sich bald ändern, denn am IOB arbeiten Scholl und seine Kollegen an einer Gentherapie, die den fortschreitenden Verlust aufhalten und damit das scharfe Sehen erhalten soll.
Das IOB hat die Stargardt-Krankheit aus mehreren Gründen als einen der Forschungsschwerpunkte ausgewählt: «Gerade weil es um Jugendliche geht, ist es eine ernst zu nehmende Krankheit, auch wenn sie nur bei etwa einem von 8 000 Menschen auftritt», so Scholl. Er hofft auch, dass die Erkenntnisse aus diesem Projekt zu Fortschritten bei der Behandlung anderer, verwandter Erkrankungen führen. Dazu gehört beispielweise die altersabhängige Makuladegeneration, die bei etwa einem Fünftel der über 65-Jährigen vorkommt und in den Industrienationen die häufigste Ursache für Erblindung im Alter darstellt.
Weiter ist es von grossem Vorteil, dass die genetischen Ursachen der Krankheit aufgeklärt sind. «Netzhauterkrankungen können durch Mutationen in vielen verschiedenen Genen ausgelöst werden, und mittlerweile sind weit über 200 solcher Gene identifiziert», sagt der Genetiker Prof. Dr. Carlo Rivolta, der Mitte 2019 eine Professur am IOB angetreten hat. «Für die Stargardt-Krankheit sind allerdings hauptsächlich Defekte in einem bestimmten Gen verantwortlich, dem ABCA4-Gen.» Menschen, die eine defekte und eine intakte Kopie dieses Gens besitzen, haben keine Beschwerden. Erst wenn ein Kind von beiden Elternteilen je eine defekte Kopie erhält, manifestiert sich die Krankheit. Der Erbgang ist also rezessiv.
Fehler gezielt reparieren
Auch die Funktion des ABCA4-Gens ist heute bekannt: Es kodiert für ein Protein, das Abbauprodukte von Vitamin A, die während des Sehprozesses entstehen, abtransportiert. Können die Sehzellen diesen Transporter aufgrund des Gendefekts nicht herstellen, sammeln sich die Abbauprodukte in der Netzhaut an und schädigen den gelben Fleck. «Für einen positiven Effekt sollte es also theoretisch ausreichen, die Funktion dieses Gens wiederherzustellen», so Rivolta.
Deswegen arbeiten die Forscher an einem Weg, das mutierte Gen direkt in den Zellen zu korrigieren. Hierzu versuchen sie eine Nukleotid-Sequenz, welche die mutierte Stelle spezifisch erkennt, in ein für den Menschen harmloses Virus zu verpacken und dieses dann direkt unter die Netzhaut der Patienten zu spritzen. Durch das Virus gelangt die Nukleotid- Sequenz in die Sehzellen. Mit ihr gekoppelte Enzyme werden zu der mutierten Stelle geleitet und aktivieren dort zelluläre Reparaturmechanismen, was zu einer zielgerichteten Korrektur des defekten Gens führt.
Ein kürzlich in den USA zugelassenes Medikament gegen frühkindliche Erblindung verdeutlicht das Potenzial der Gentherapie bei der Behandlung von Erkrankungen des visuellen Systems. Weiter zeigen bisherige Untersuchungen, dass die Wirkung einer solchen Therapie über viele Jahre anhalten kann – ob ein ganzes Leben lang, wird sich durch Langzeitbeobachtungen der behandelten Patienten und Patientinnen zeigen.
Schneller vom Labor in die Klinik
Ein weiteres Ziel von Scholl ist es, den Weg von der Grundlagenforschung bis zur klinischen Anwendung zu verkürzen. Dabei können die innovativen Methoden helfen, die Forschungsgruppen am IOB entwickelt haben. So ist es nun möglich, aus winzigen Hautproben von Patienten kleine Zellhaufen zu züchten, deren Zusammensetzung dem Gewebe der Netzhaut entspricht. Mithilfe dieser sogenannten Organoide können die Wissenschaftler gentherapeutische Ansätze in der Petrischale testen. «Dies reduziert nicht nur die Zahl der Tierversuche, sondern erlaubt es uns auch, schneller zu Studien mit Patienten zu kommen», sagt Scholl.
Andere Gruppen arbeiten parallel daran, die Toxizität einer solchen Therapie zu analysieren und Messmethoden für die Wirkung zu etablieren. Aufgrund dieser Fortschritte hält es Scholl für realistisch, dass die Gentherapie für die Stargardt-Krankheit schon innerhalb der nächsten fünf Jahre in einer klinischen Studie getestet werden kann. Dafür rekrutiert er schon jetzt geeignete Patienten und Patientinnen aus ganz Europa.
Scholl warnt jedoch vor überhöhten Erwartungen: «Eine völlige Wiederherstellung des scharfen Sehens lässt sich durch die Gentherapie ziemlich sicher nicht erreichen, denn bei den Patienten sind viele Zellen der Netzhaut leider unwiderruflich zerstört. » Doch der Forscher ist trotzdem optimistisch, dass sich das Sehvermögen der Erkrankten merkbar verbessern lässt. Und sollte sich die Methode bewähren, könnten betroffene Kinder in der ferneren Zukunft schon in jungen Jahren eine vorbeugende Gentherapie erhalten, sodass die Krankheit gar nicht erst zum Ausbruch kommt.
Weitere Artikel in der aktuellen Ausgabe von UNI NOVA.